Witaj :)
Naszym zadaniem jest wyjaśnić, dlaczego helowce w warunkach normalnych nie występują w postaci cząsteczek dwuatomowych.
Jak wiemy, każdy pierwiastek chemiczny dąży do tego, aby posiadać trwałą konfigurację elektronową. Pierwiastki dążą do tego, aby posiadać na ostatniej powłoce (powłoce walencyjnej) osiem, lub dwa elektrony. Jest to tzw. Reguła oktetu (lub dubletu), lub reguła helowca. Reguła oktetu mówi o tym, że pierwiastki chemiczne dążą do uzyskania ośmiu elektronów na powłoce walencyjnej, czyli do konfiguracji najbliższego dla nich gazu szlachetnego. Dla reguły dubletu pierwiastki dążą do uzyskania dwóch elektronów na powłoce walencyjnej (konfiguracji helu). Jeżeli spojrzymy na układ okresowy pierwiastków, zauważamy, że gazy szlachetne (helowce) znajdują się w 18 grupie, czyli na ostatniej powłoce posiadają 18-10=8 elektronów walencyjnych (z wyjątkiem helu, który ma 2 elektrony walencyjne). Pierwiastki te posiadają trwałą konfigurację powłoki walencyjnej, mają oktet albo dublet (dla helu). Niekorzystnie byłoby dla nich oddać lub przyjąć elektrony, więc nie mają możliwości tworzenia cząsteczek dwuatomowych.
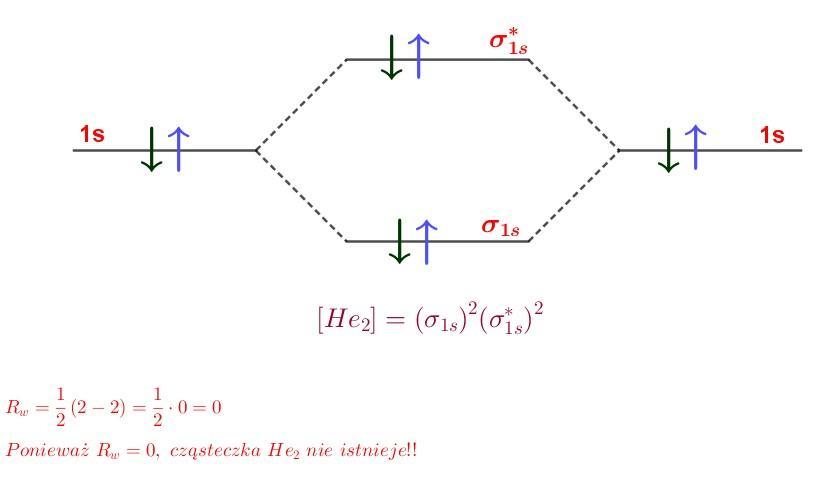
Drugim dokładniejszym sposobem na wytłumaczenie tego, że gazy szlachetne (helowce) nie tworzą cząsteczek dwuatomowych, jest zastosowanie teorii orbitali molekularnych. W załączniku znajduje się diagram energetyczny dla cząsteczki dwuatomowej helu. Jak wiemy, atom helu posiada 2 elektrony walencyjne, ale mamy cząsteczkę dwuatomową, więc tych elektronów będzie 2 razy więcej, czyli 4. W najniższym miejscu diagramu mamy orbital wiążący [tex]\sigma_{1s}[/tex]. Na tym orbitalu mogą znaleźć się 2 elektrony o przeciwnych spinach. Na samej górze mamy orbital antywiążący [tex]\sigma^*_{1s}[/tex]. Na tym orbitalu mogą znaleźć się również 2 elektrony. Parametrem, który opisuje, czy dana cząsteczka może istnieć, jest tzw. rząd wiązania. Rząd wiązania jest połową różnicy między ilością elektronów na orbitalu wiążącym a ilością elektronów na orbitalu antywiążącym. Możemy to wyrazić wzorem:
[tex]\Large \boxed{R_w=\frac{1}{2}\Big(n_e-n^*_e\Big) }[/tex]
gdzie:
[tex]n_e\ - \ ilosc\ elektronow\ na\ orbitalu\ wiazacym\\n^*_e\ - \ ilosc\ elektronow\ na\ orbitalu\ antywiazacym[/tex]
W naszym przypadku mamy:
[tex]n_e=2\\n^*_e=2[/tex]
Więc rząd wiązania wynosi:
[tex]\Large \boxed{R_w=\frac{1}{2}\cdot(2-2)=\frac{1}{2}\cdot 0=0\implies He_2\ nie\ istnieje }[/tex]
Analogicznie możemy postąpić dla innych gazów szlachetnych, co potwierdza, że nie występują one w postaci cząsteczek dwuatomowych.
W załączniku diagram energetyczny dla cząsteczki helu.