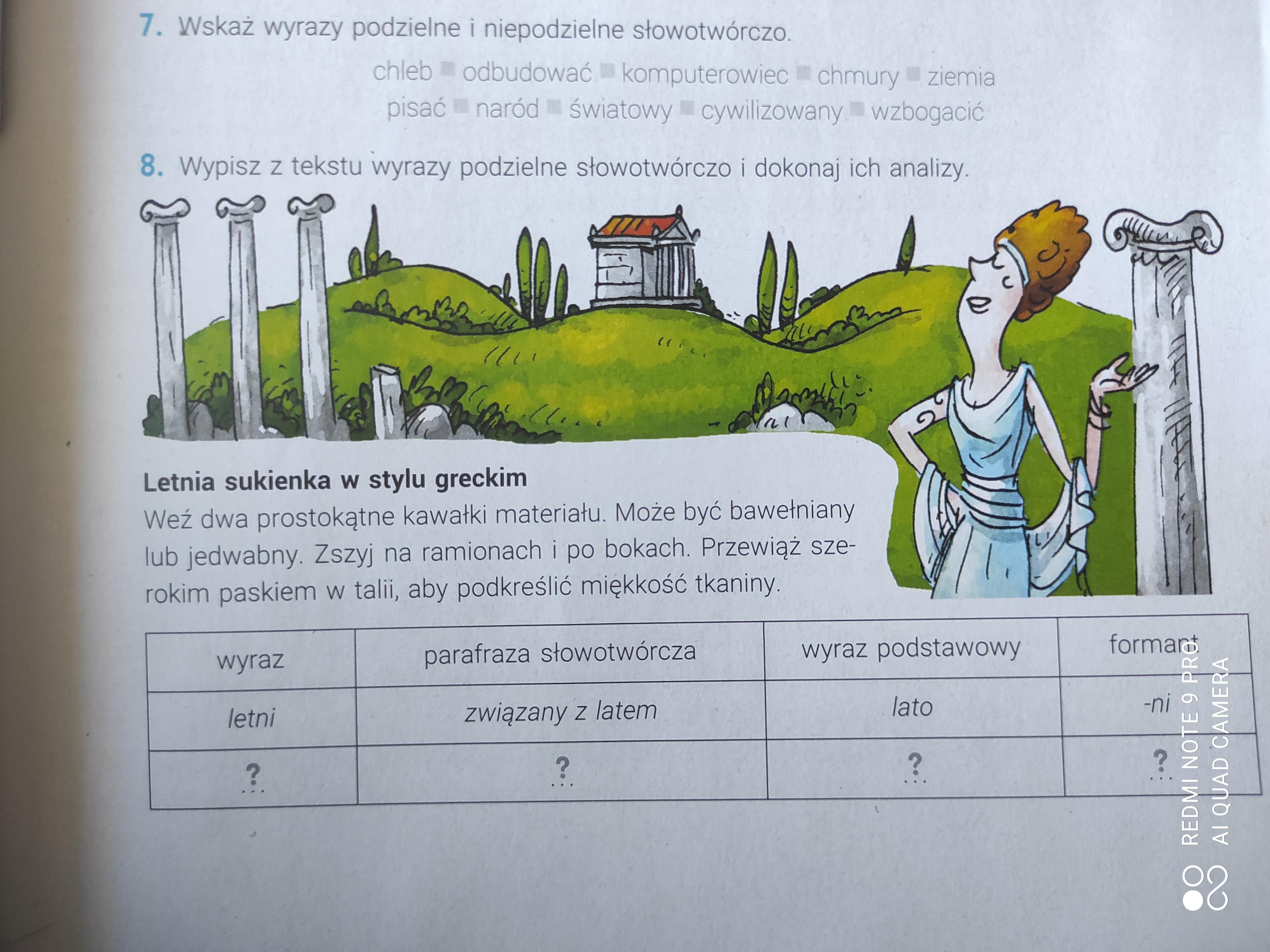
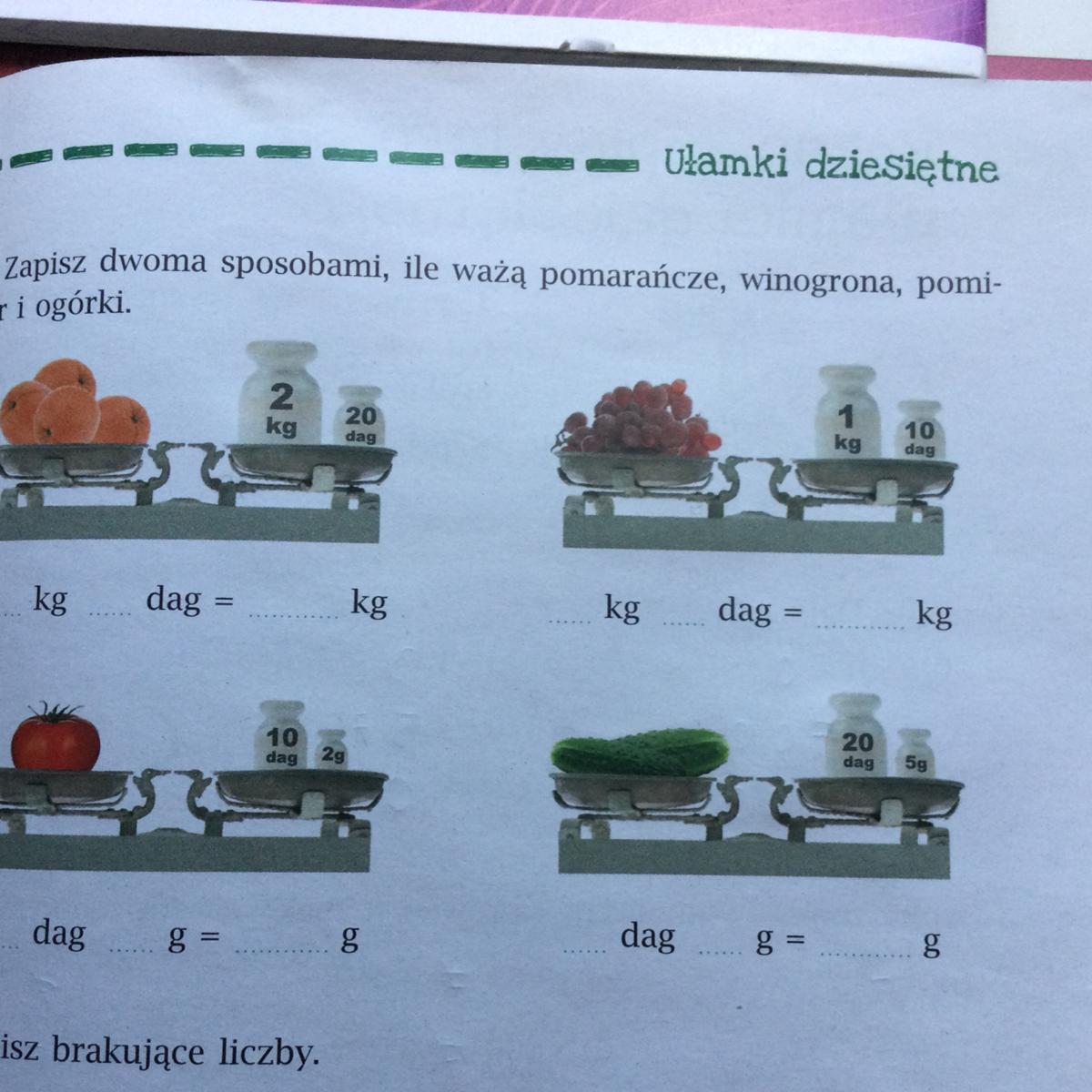
Proszę i wykonanie tych dwóch zadań, daje naj✨

-
Temat:
Historia -
Autor:
maximiliano -
Utworzono:
1 rok temu
Odpowiedzi 1
5. Nazwą ,,małe Curie" określano w czasie wojny : B. Samochody z aparatami rentgenowskimi 6. adresat: ( napisz jakieś losowe imię i nazwisko)cel: Uroczyste otwarcie Instytutu Radowego w Warszawie,po którym odbędzie się wywiad z Marią Skłodowską-Curie na temat jej odkryć promieniotwórczych pierwiastków i zastosowaniu radu w leczeniu nowotworów.czas: 29 maja 1932 rokumiejsce spotkania: Warszawa, ul.Wawelska 15nadawca: ( i tu tez losowe)mam nadzieje ze pomogłam :)
-
Autor:
ariaqddm
-
Oceń odpowiedź:
5
Znasz odpowiedź? Dodaj ją tutaj!
Wybierz język i region
How much to ban the user?
1 hour
1 day
100 years