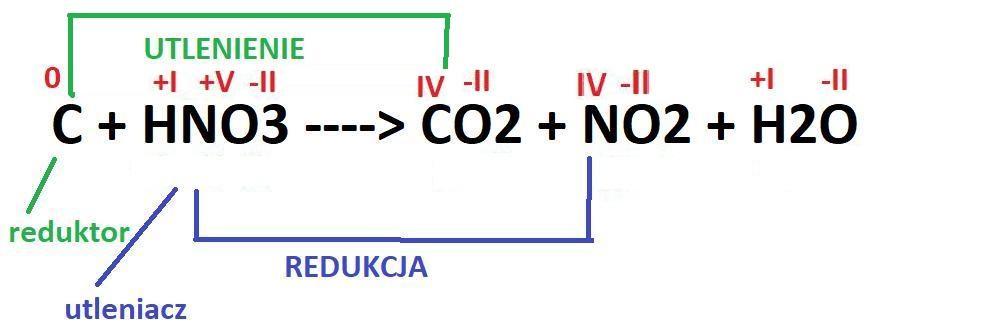
Stopnie utlenienia zaznaczone w załączniku.
W reakcji węgiel (C) przechodzi z 0 stopnia utlenienia na +IV stopień utlenienia w [tex]CO_2[/tex], a azot z +V stopnia utlenienia w [tex]HNO_3[/tex] przechodzi na +IV w [tex]NO_2[/tex].
Azot jest więc utleniaczem (akceptuje elektrony) i ulega redukcji.
Węgiel jest reduktorem (oddaje elektrony) i ulega utlenieniu.
Zapisujemy reakcje połówkowe, a następnie wymnażamy je tak, aby w obu reakcjach była taka sama liczba elektronów:
[tex]C -- > C^{4+} + 4e^- ||*1 \\\\N^{5+} + e^- -- > N^{4+} ||*4 \\[/tex]
Przepisujemy uzyskane współczynniki do równania wyjściowego i uzgadaniamy brakujące współczynniki:
[tex]C + 4 HNO_3 --- > CO_2 + 4 NO_2 +2H_2O[/tex]
Reakcje utlenienia i redukcji
Reakcje utlenienia i redukcji (reakcje redox) to reakcje, które przebiegają z transferem elektronów między substratami biorącymi udział w reakcji. Podczas reakcji zmieniają się stopnie utlenienia atomów w związkach.
Na całość reakcji redox składają się:
- reakcja utlenienia, czyli proces oddania elektronów przez reduktor, który podwyższa swój stopień utlenienia;
- reakcja redukcji, czyli proces przyjęcia elektronów przez utleniacz i obniżenie jego stopnia utlenienia
Metoda bilansu elektronowego
Metoda bilansu elektronowego to metoda w której odszukujemy i bilansujemy reakcje połówkowe wyłącznie z wykorzystaniem pierwiastków, których atomy zmieniają swój stopień utlenienia. Następnie uzyskane współczynniki przepisujemy do równania wyjściowego i uzgadniamy brakujące współczynniki.