Oblicz sposobem pisemnym: 3,822+8+5,18 1,4-1,496 50*6*7 1995:15 4,27+7+5,633 1,5-0,597 68*72 2055:15.
-
Temat:
Matematyka -
Autor:
krystal -
Utworzono:
1 rok temu
Odpowiedzi 1
Odpowiedź:
szczegóły w załączniku :)
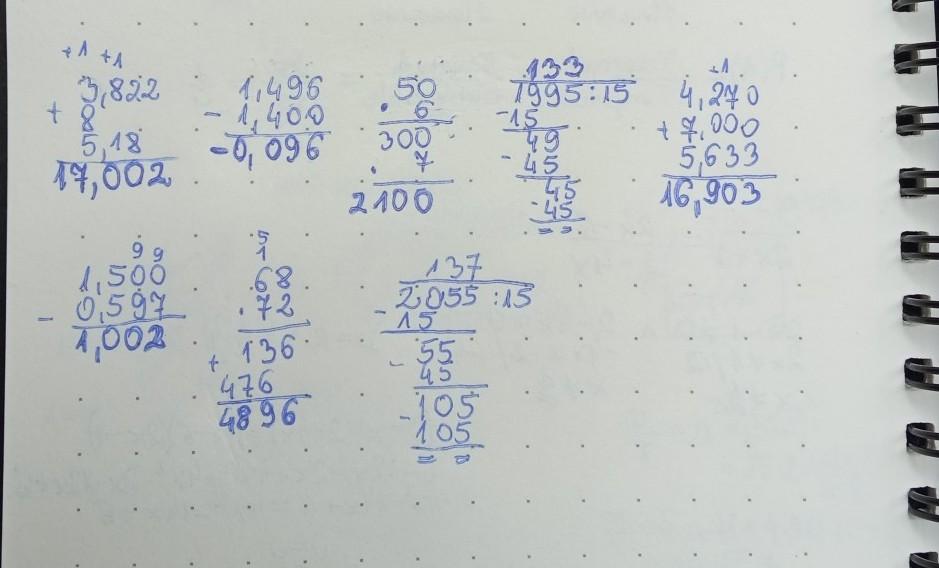
-
Autor:
aresiokxbh
-
Oceń odpowiedź:
2
Znasz odpowiedź? Dodaj ją tutaj!
Wybierz język i region
How much to ban the user?
1 hour
1 day
100 years
